العدد الكتلي أساس ترتيب عناصر الجدول الدوري من المعلومات الشائعة بين الناس، ولكن نريد أن نتعرف إلى مدى صحة هذه المعلومة، لذا سنوضح اليوم من خلال موقع زيادة هل العدد الكتلي أساس ترتيب العناصر الجدول الدوري أم لا.

العدد الكتلي أساس ترتيب عناصر الجدول الدوري
يعتبر العدد الكتلي هو أحد الأرقام المعبرة عن العناصر الكيميائية، حيث يمكن تعريف العدد الكتلي على أنه مجموع عدد البروتونات الموجبة والنيترونات المتعادلة المتواجدة داخل النواة.
لكن بالنسبة لصحة معلومة أن العدد الكتلي أساس ترتيب عناصر الجدول الدوري، فهذه معلومة غير صحيحة، حيث إن الجدول الدوري يتم ترتيبه على أساس العدد الذري.
يمكن القول إن النمط الذي يتم ترتيب العناصر به على أساس العدد الذري في الجدول الدوري هو نمط تصاعدي يتم على أساس الزيادة في هذا العدد.
وبهذا تكون معلومة أن العدد الكتلي أساس ترتيب عناصر الجدول الدوري خاطئة وعليك تصحيحها بان العدد الذري هو الأساس الذي يتم على أساسه ترتيب العناصر في الجدول الدوري.
اقرأ أيضًا: ما هو العدد الذري
تصنيف الجدول الدوري
أوضحنا فيما سبق مدى صحة عبارة أن العدد الكتلي أساس ترتيب عناصر الجدول الدوري، وسنعرض الآن تصنيف الجدول الدوري حيث قام أكثر من عالم بتصنيف الجدول الدوري على أساس عوامل مختلفة، ومن ضمن هذه التصنيفات ما يلي:
- قام العالم بريزيليوس بتصنيف الجدول الدوري على أساس فلزات ولا فلزات.
- العالم مندليف رتب العناصر على أساس ترتيبها التصاعدي وذلك بناءً على أوزانها الذرية، ومن الممكن أن تتكرر الخواص الكيميائية الفيزيائية في الدورة الواحدة.
- أما العالم موزلي فقد قام بترتيب العناصر بشكل تصاعدي على أساس الأعداد الذرية.
- تم تقسيم العناصر في الجدول الدوري على أساس النمط التصاعدي، وذلك من خلال إمكانية ملء مستويات الطاقة الفرعية.
ترتيب الجدول الدوري
يتم ترتيب الجدول الدوري على أساس علمي، حيث إن العناصر الكيميائية في الجدول يتم ترتيبها من اليسار إلى اليمين، ومن الجهة العليا إلى الجهة السفلى وذلك وفقًا للعدد الذري كما أوضحنا مُسبقًا.
يقسم الجدول الدوري إلى صفوف وأعمدة فالصفوف في الجدول تسمى دورات والأعمدة في الجدول الدوري تسمى بمجموعات، ورقم الدورة للعنصر الواحد يدل على أكبر مستوى يمكن أن يشغله الإلكترون.
كما أن العناصر المرتبة في العمود الواحد يكون لها تركيبات الإلكترون المتماثلة، وبالتالي تكون متشابهة في الخواص الكيميائية.
هناك بعض العوامل التي يعتمدها العلماء للتعرف إلى طريقة ترتيب العناصر في الجدول الدوري، ومن ضمن هذه العوامل ما يلي:
- طريقة ملء مدارات الطاقة بالإلكترونات.
- وجود زيادة في العدد الذري للعناصر.
- وجود تشابه بين العناصر التي تحتوي على عدد الإلكترونات نفسه لمدارات الطاقة الخارجية؛ في الخواص الكيميائية.
خصائص العناصر في الجدول الدوري
بعد أن أوضحنا خطأ أن العدد الكتلي أساس ترتيب عناصر الجدول الدوري، سنهتم بعرض خواص العناصر الكيميائية، حيث يوجد أكثر من خاصية يمكن التعرف إلى العناصر الكيميائية في الجدول الدوري من خلالها، ومن هذه الخصائص ما يلي:
1- نصف قطر الذرة
هناك علاقة عكسية بين قيمة العدد الذري ونصف قطر الذرة، حيث إنه يقل نصف قطر الذرة في الدورات الأفقية بزيادة العدد الذري، وذلك بالاتجاه إلى الجهة اليمنى من الجدول الدوري، بسبب زيادة شحنات النواة الموجبة، وكذلك قوى التجاذب بين النواة والإلكترونات للمدار الأخير من الذرة والمعروفة بإلكترونات التكافؤ، مما يقلل من قطر الذرة.
2- جهد التأين للعنصر الكيميائي
هناك علاقة طردية بين العدد الذري وقيمة جهد التأين، حيث إنه تزداد قيمة جهد التأين كلما زاد العدد الذري، وذلك بسبب قلة القطر الذري، وزيادة نسبة قوى التجاذب بين إلكترونات التكافؤ والنواة.
كما أن قيمة جهد التأين في المجموعات الرأسية وذلك بسبب زيادة العدد الذري، وزيادة نصف قطر الذرة، بالإضافة إلى عدد مستويات الطاقة.
3- الخواص الفلزية واللافلزية للمادة
تعد الخاصية الفلزية والغير فلزية من الخواص التي يمكن تقيمها على حسب اتجاه الجدول الدوري حيث إن:
- الخاصية الفلزية للمادة: تزداد للمادة كلما اتجهنا من الجهة العليا إلى السفلى في الجدول، فمثلًا في المجموعة A1 يمكن اعتبار عنصر الليثيوم من العناصر القليلة في الخاصية الفلزية.
على نفس المنوال يمكن اعتبار أن عنصر السيزيوم هو أعلى العناصر الكيميائية فلزية
- أما الخاصية اللافلزية للمادة فتقل بصورة تدريجية، وذلك كلما اتجهنا من الجهة اليسرى إلى الجهة اليمنى في الجدول الدوري للدورة الواحدة.
4- كهروسالبية العنصر
تتوقف كهروسالبية العناصر على العدد الذري للعناصر، حيث إنها تزداد في الدورات الأفقية، وبالتالي تزداد الشحنة الموجبة الفعالة للنواه وقوى التجاذب.
كما أنها تقل في المجموعات الرأسية وذلك بسبب الارتفاع في العدد الذري، بسبب زيادة نصف قطر الذرة، ويوجد حجز بين قوى تجاذب النواة ومستويات الطاقة الممتلئة.
اقرأ أيضًا: ما هي العناصر الموجودة على يسار الجدول الدوري
أنواع العناصر في الجدول الدوري
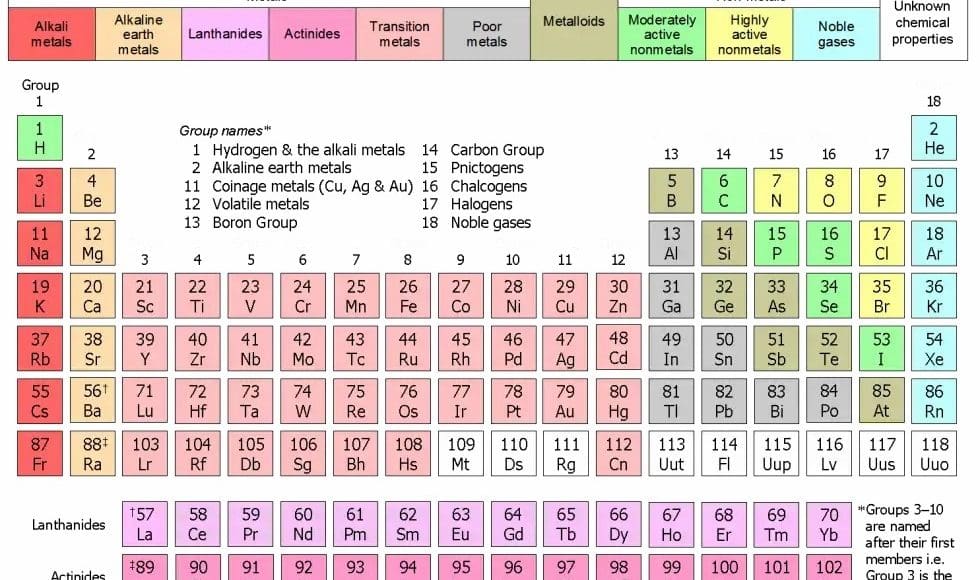
في إطار توضيح صحة عبارة العدد الكتلي أساس ترتيب عناصر الجدول الدوري والتي تم الوصول إلى أنها خطأ شائع، سنتطرق الآن إلى معرفة أنواع العناصر في الجدول الدوري، حيث يحتوي الجدول الدوري على سبع دورات تتواجد بصورة أفقية، ويوجد ثمانية مجموعات رأسية تمثل عناصر المجموعة A، وتتوجد عشرة مجموعات رأسية تعبر عن العناصر الانتقالية، كما أن في أسفل الجدول الدوري تمثل مجموعات اللانثانيدات والأكتيندات.
يمكن تجزئة الجدول الدوري إلى أربع مجموعات وتحمل كل مجموعة من المجموعات حرف أبجدي، وتكون هذه الحروف كالتالي: S و P و D و F.
يتم تقسيم أنواع العناصر في الجدول إلى عدة أقسام كالتالي:
- العناصر الخاملة: هذه العناصر تعرف باسم الغازات النبيلة، وهي عناصر تنتمي إلى المجموعة الصفرية ويمكن تميزها على أساس أن مستويات طاقته ممتلئة بشكل تام.
يتم تصنيف التركيب الكيميائي لهذه العناصر كالتالي np6 ns2، كما أن عنصر الهيليوم يكون تصنيفه الكيميائي كالتالي s21.
- العناصر الانتقالية الرئيسية: هي عناصر المجموعة D، ويمكن تمييز هذه العناصر من حيث إن جميع مستويات طاقتها ممتلئة ما عدا المستويين الأخيرين.
- العناصر الانتقالية الداخلية: هي مجموعة تتضمن عناصر الفئة F ويمكن تمييزها بأن مستويات طاقتها ممتلئة ما عدا الثلاث مستويات الأخيرة.
عناصر الجدول الدوري
في سياق معرفة أساس تقسيم الجدول الدوري وهل العدد الكتلي أساس ترتيب عناصر الجدول الدوري أم لا، سنتعرف على أن يتم تقسيم الجدول الدوري إلى ثمانية مجموعات سنعرض كل مجموعة منهم على حدا فيما يلي:
1- عناصر المجموعة الأولى (مجموعة الفلزات القلوية)
المجموعة الأولى من الجدول الدوري تتضمن عناصر الفلزات القلوية والهيدروجين، وتتميز هذه المجموعة بأنها تحتوي على إلكترون واحد يوجد في الغلاف الخارجي لها، ويطلق على هذه المجموعة أيضًا رمز A1.
من مميزات هذه المجموعة أن كثافة العناصر أقل من كثافة باقي الفلزات، ويكون نصف قطر الذرة لعناصر هذه المجموعة أكبر من نصف قطر العناصر الموجودة في الدورة، كما أن لهذه المجموعة طاقة تأين قليلة وكهروسالبية قليلة، وعناصر هذه المجموعة ما يلي:
- الهيدروجين H
- الليثيوم Li
- الصوديوم Na
- البوتاسيوم K
- الرابيديوم Rb
- السيزيوم Cs
- الفرانسيوم Fr
2- عناصر المجموعة الثانية (مجموعة الفلزات الترابية القلوية)
هذه المجموعة يرمز إليها بالرمز A2 وتكون جميع الفلزات في هذه المجموعة عناصر فلزية تفاعلية، كما أنها تتميز بأن ألوانها تكون مميزة عند في حالة الاشتعال.
عناصر المجموعة الثانية تحتوي على إلكترونين في الغلاف الجوي الخارجي الفرعي، وتتميز عناصر هذه المجموعة بأنها قادرة على تجميع الكاتيونات الثنائية التكافؤ بيسر، ويمكن أن يكون لهذه المجموعة تقارب قليل في الإلكترونات بالإضافة إلى كهروسالبية منخفضة، وعناصر هذه المجموعة كالآتي:
- البيريليوم Be
- المغنيسيوم Mg
- الكالسيوم Ca
- السترونتيوم Sr
- الباريوم Ba
- الراديوم Ra
اقرأ أيضًا: الجدول الدوري الحديث للعناصر
3- عناصر المجموعة الثالثة (مجموعة البورون)
يرمز إلى هذه المجموعة بالرمز A3 وكل عناصر هذه المجموعة هي عناصر فلزية ما عدا عنصر البورون حيث إنه عنصر شبه فلز، ويحتوي كل من العنصرين البورون والألومنيوم على ثلاثة إلكترونات فقط في الغلاف الإلكتروني الخارجي للمجموعة، ويمكن تقسيم عناصر المجموعة إلى الآتي:
- البورون B
- الألمنيوم Al
- الجاليومGa
- الإنديوم In
- الثاليوم Tl
- النيهونيوم Nh
4- عناصر المجموعة الرابعة (مجموعة الكربون)
يرمز على هذه المجموعة بالرمز 4A أو بالرقم 14، ويوجد بهذه المجموعة خليط من عناصر الفلزات واللافلزات وأشباه الفلزات، ويوجد في الغلاف الخارجي الإلكتروني لذرات الكربون والسيليكون أربعة إلكترونات فقط، وعناصر هذه المجموعة تكون كالتالي:
- الكربون C
- السيليكون Si
- الجيرمانيوم Ge
- القصدير Sn
- الرصاص Pb
- الفليروفيوم Fl
5- عناصر المجموعة الخامسة (مجموعة النيتروجين)
يرمز إلى هذه المجموعة بالرمز 5A أو الرقم 15، ويوجد بهذه المجموعة خليط من العناصر المختلفة سواء كانت فلزات أو لا فلزات أو أشباه فلزات، ويحتوي الغلاف الخارجي الإلكتروني لعناصر النيتروجين والفوسفور على خمس إلكترونات فقط لغلاف التكافؤ الخارجي، وعناصر هذه المجموعة كالآتي:
- النيتروجين N
- الفسفور P
- الزرنيخ As
- الأنتيمون Sb
- البزموث Bi
- المسكوفيوم Mc
6- عناصر المجموعة السادسة (مجموعة الأكسجين)
هذه المجموعة يرمز إليها بالرمز 6A أو الرقم 16، ويمكن اعتبار هذه المجموعة من ضمن المجموعات الانتقالية، وتحتوي على مجموعة من الفلزات واللافلزات وأشباه الفلزات، وعناصر الأكسجين والكبريت في هذه المجموعة تحتوي على ستة إلكترونات في الغلاف الخارجي لها، وعناصر هذه المجموعة كالآتي:
- الأكسجين O
- الكبريت S
- السيلسنيوم Se
- التيليريوم Te
- البولونيوم Po
- الليفرموريوم Lv
7- عناصر المجموعة السابعة (مجموعة الهالوجينات)
يرمز إلى عناصر هذه المجموعة بالرمز 7A أو الرقم 17، وتضم هذ المجموعة العناصر اللافلزية شديدة التفاعل، كما أن هذه هي المجموعة الوحيدة الموجودة في الجدول الدوري التي تحتوي على عناصر كيميائية في الحالات الثلاث للمادة في الظروف القاسية للغرفة من درجة حرارة وضغط.
نلاحظ أن في هذه المجموعة الفلور والكلور غازات، والبروم سائل بالإضافة إلى أن اليود صلب.
الهالوجينات من العناصر التي تختلف فيها الخواص الفيزيائية على عكس أنها تشترك في الخواص الكيميائية ومن ضمن هذه الخصائص هي الكهروسالبية العالية، بالإضافة على أن هذه العناصر تتفاعل بشكل كبير، وعناصر هذه المجموعة هم سبعة إلكترونات تكافؤ، وحالة تأكسد عناصر هذه المجموع هي -1، وعناصرها هي:
- الفلور F
- الكلور Cl
- البروم Br
- اليود I
- الأستاتين At
- التينيسين Ts
اقرأ أيضًا: أول عنصر في الجدول الدوري
8- عناصر المجموعة الثامنة (مجموعة العناصر النبيلة)
يُرمز إلى عناصر هذه المجموعة بالرمز 8A أو الرقم 18، ويتم تسمية هذه المجموعة باسم الغازات النبيلة بسبب أنها في أغلب الحالات لا تتفاعل، وتحتوي على غلاف إلكتروني خارجي مكتمل، كما أن لديها كهروسالبية منخفضة وتقارب في الإلكترونات، وعناصر هذه المجموعة كالتالي:
- الهيليوم He
- النيون Ne
- الآرجون Ar
- الكريبتون Kr
- الزينون Xe
- الرادون Rn
- الأوغانيسون Og
العدد الكتلي أساس ترتيب عناصر الجدول الدوري من المعلومات الغير صحيحة الشائعة بين الناس، والصحيح هو أن العدد الذري هو من يقوم عليه ترتيب العناصر في الجدول الدوري.